GMMG-HD10/DSMM XX/64007957MMY2003-Studie
EudraCT: 2022-001186-12
Sponsor: Universitätsklinikum Heidelberg
LKP: Prof. Dr. med Marc S. Raab
Titel: Phase-2-Studie zur Bewertung der Sicherheit und Wirksamkeit von Teclistamab in Kombination mit Daratumumab, Lenalidomid und Dexamethason mit und ohne Bortezomib als Induktionstherapie und Teclistamab in Kombination mit Daratumumab und Lenalidomid als Erhaltungstherapie bei transplantationsgeeigneten Patienten mit neu diagnostiziertem Multiplem Myelom.
Studienziel/Fragestellung:
Bei der GMMG-HD10/DSMM XX-Studie, die im November 2022 gestartet ist, handelt es sich um eine gemeinsame Phase 2-Studie der GMMG mit der Deutschen Studiengruppe Multiples Myelom (DSMM), in der eine Fünffach-Kombination in der Induktionstherapie geprüft wird. Eine Neuerung der Studie ist die Hinzunahme eines zweiten Antikörpers, Teclistamab, zu der Kombination aus Daratumumab (Dara), Lenalidomid (R), Bortezomib (V) und Dexamethason (d). Teclistamab (Tec) ist ein bispezifischer Antikörper, der zum Einen an den CD3-Rezeptorkomplex auf der Oberfläche von T-Zellen, und zum Anderen an das Protein BCMA (B-cell maturation antigen) auf der Oberfläche von Myelomzellen bindet. Die Bindung an den CD3-Komplex führt zur Aktivierung der T-Zelle, die daraufhin die am anderen Arm des Antikörpers gebundene Myelomzelle abtötet. Wegen seiner Fähigkeit, T-Zellen “einzufangen”, wird Teclistamab als ein T-cell engager bezeichnet.
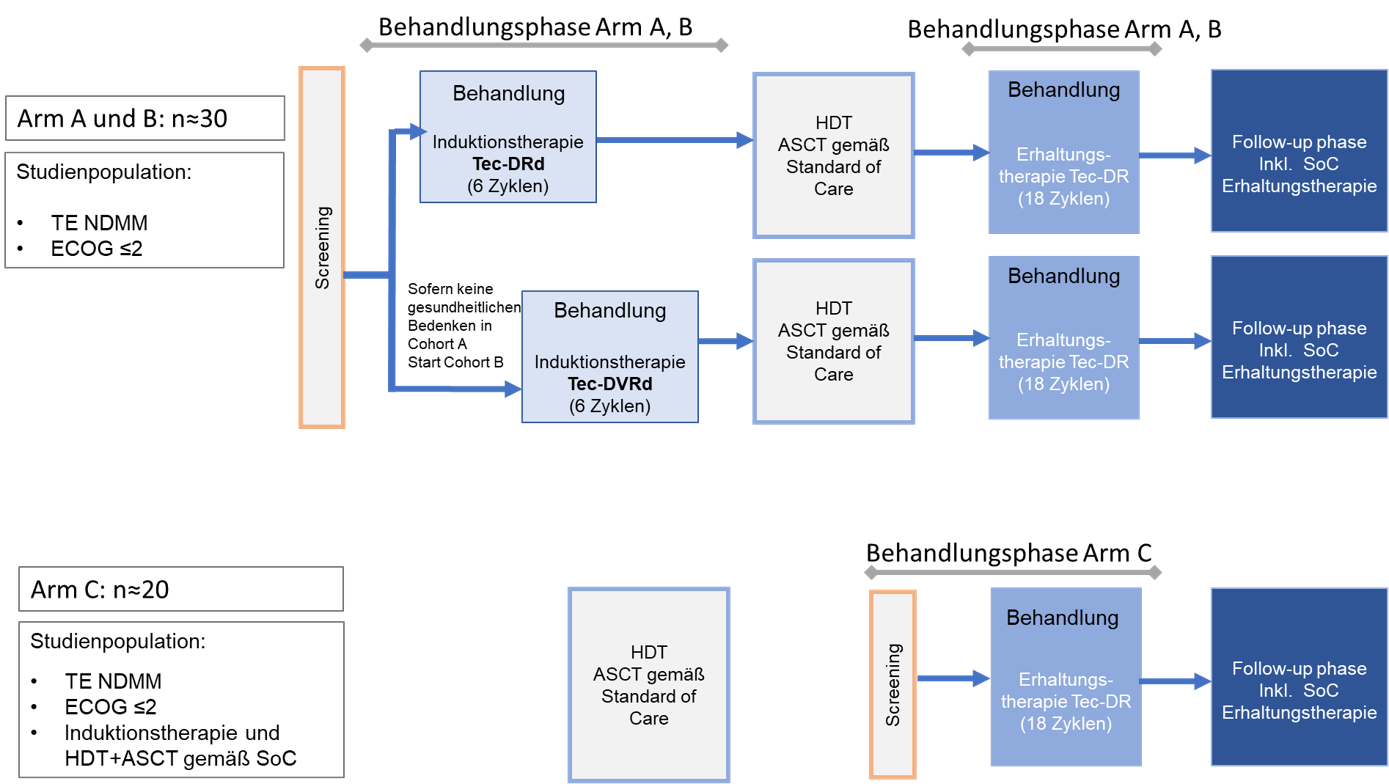
Das Studiendesign gliedert sich in drei Studienarme, wobei Arm A und B eine Induktionstherapie mit Tec-Dara-Rd (Arm A) oder Tec-Dara-VRd (Arm B) erhalten. Nach einer Hochdosis-Chemotherapie gefolgt von einer autologen Stammzelltransplantation (HDT+ASCT) gemäß Standard of Care wird eine Erhaltungstherapie mit Tec-Dara-R in Arm A und B durchgeführt.
Arm C untersucht eine Erhaltungstherapie mit Tec-Dara-R im Anschluss an eine gemäß SOC durchgeführte Induktions-, HDT+ASCT und gegebenenfalls Konsolidierungstherapie
Für die Arme A und B sind ca. n=30, für Arm C n=20 Teilnehmer vorgesehen.
Primäres Studienziel für die Arme A und B ist die Bestimmung der Sicherheit und Verträglichkeit von Teclistamab in Kombination mit Dara-Rd oder Dara-VRd als Induktionstherapie, sowie Teclistamab in Kombination mit Dara-R als Erhaltungstherapie nach Standard- HDT+ASCT bei neu diagnostizierten Patienten. Bestimmt werden die Häufigkeit und Schwere von auftretenden unerwünschten Ereignissen. Die sekundären Ziele umfassen unter anderem die Bestimmung der Wirksamkeit der jeweiligen Kombinationstherapie, Raten der MRD-Negativität, das Therapieansprechen und das progressionsfreie Überleben.
Die Behandlungsdauer der Induktionsphase beträgt 6 Zyklen (à 28 Tage). Aus Sicherheitserwägungen wird zunächst mit Arm A (Tec-Dara-Rd) begonnen. Sofern die Patientensicherheit gewährleistet ist, werden Patienten in Arm B (Tec-Dara-VRd) eingeschlossen, in dem eine zusätzliche Bortezomib-Behandlung vorgesehen ist.
Nach 6 Zyklen Induktionstherapie schließt sich eine Hochdosis-Chemotherapie + ASCT gemäß Standard of Care an. Nach Abschluss der ASCT beginnt die Erhaltungsphase der Studie unter Tec-Dara-R mit einer Dauer von 18 Zyklen.
Studienarm C beginnt mit dem Screening nach abgeschlossener Hochdosis-Chemotherapie + ASCT gemäß Standard of Care. Die Behandlung erfolgt genauso wie in Arm A und B mit Tec-Dara-R als Erhaltungstherapie für 18 Zyklen.
Die Follow-Up Phase wird nach „end of treatment“ (EOT) oder 18 Zyklen Erhaltungstherapie erreicht. Während des Follow-ups sind weitere Therapien nach Entscheidung des Prüfarztes und gemäß lokaler Standards erlaubt.