GMMG-HD9/DSMM XVIII-Studie
EU CT Nr: 2023-507402-13-00
Sponsor: Universitätsklinikum Heidelberg
LKP: Prof. Dr. med Hartmut Goldschmidt
Titel: Randomisierte Phase 3-Studie zur Untersuchung einer Erhaltungstherapie mit Iberdomid versus Iberdomid plus Isatuximab nach autologer hämatopoetischer Blutstammzelltransplantation für Patienten mit neudiagnostiziertem Multiplem Myelom.
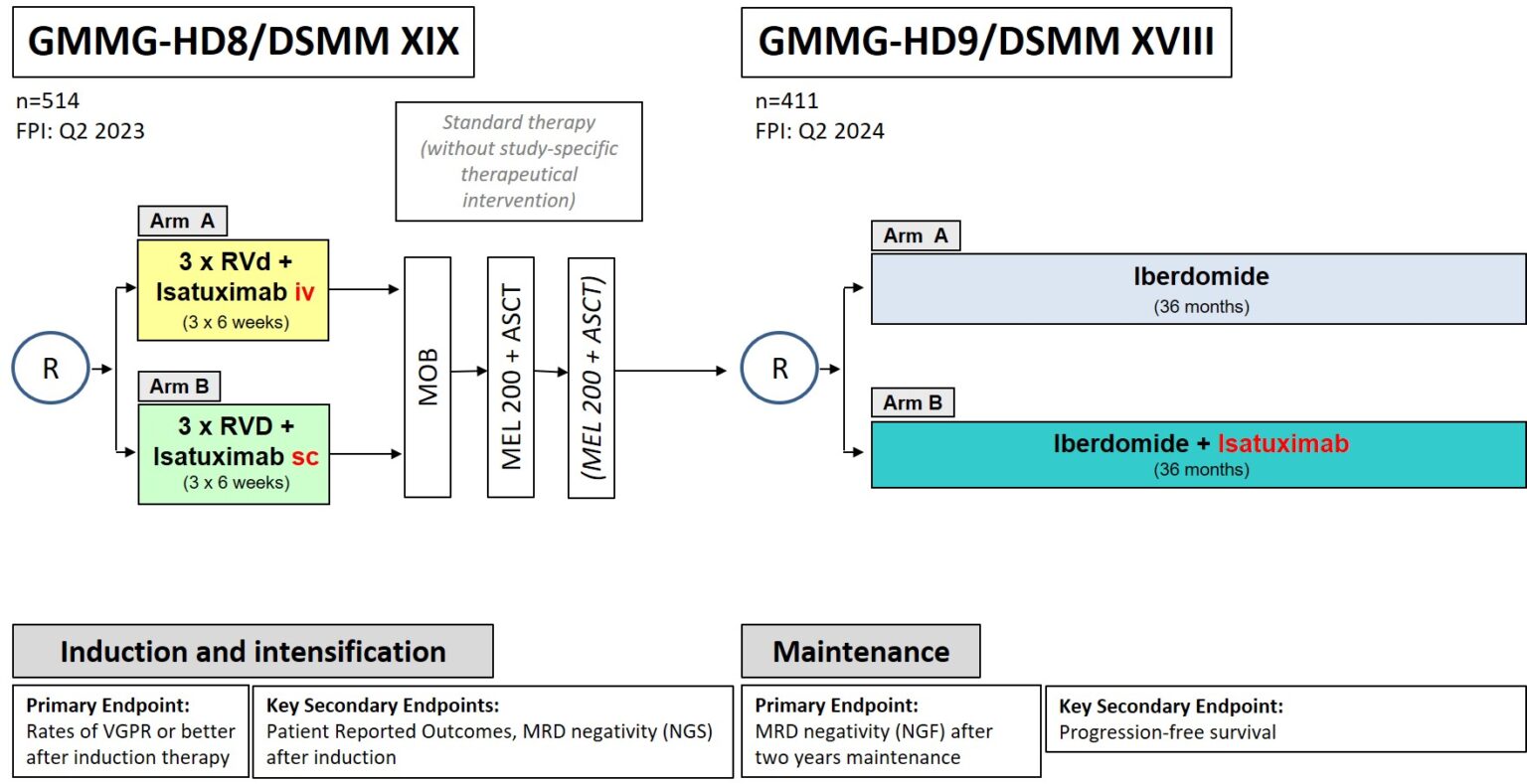
Studienziel/Fragestellung: Diese klinische Phase III-Studie stellt ein direktes Anschlusskonzept (Erhaltungstherapie) zu der GMMG-HD8/DSMM XIX-Studie dar, die die Medikamente Lenalidomid, Bortezomib und Dexamethason mit dem monoklonalen Antikörper Isatuximab (Sarclisa®) zu einem Induktionstherapie-Schema kombiniert hat. In die GMMG-HD9/DSMM XVIII-Studie sollen Patienten eingeschlossen werden, die diese Induktionstherapie, gefolgt von einer Hochdosistherapie und autologer Stammzelltransplantation, durchlaufen und mindestens ein Teilansprechen auf die Therapie gezeigt haben. In dieser Studie wird in beiden Armen das Medikament Iberdomid verwendet, im Arm B ergänzt durch die subkutane Gabe von Isatuximab. Iberdomid funktioniert nach einem ähnlichen Mechanismus wie das Medikament Lenalidomid, bisherige Studienergebnisse deuten aber auf eine bessere Verträglichkeit und Wirksamkeit hin (u.a. auf Krebszellen, die gegen Lenalidomid resistent geworden sind). Die Hinzunahme von Isatuximab könnte zu einem tieferen Ansprechen auf die Therapie und der Verlängerung der Zeit bis zum Rezidiv der Erkrankung führen.
Das Ziel der Studie ist die Prüfung, ob die Behandlung mit den Medikamenten Iberdomid und Isatuximab (Arm B) gegenüber der Behandlung mit dem Medikament Iberdomid alleine (Arm A) überlegen ist.
GMMG-HD9/DSMM XVIII ist eine weitere gemeinsame Phase III-Studie mit der Deutschen Studiengruppe Multiples Myelom (DSMM). Zunächst ist der Studienstart nur in Deutschland erfolgt, die österreichischen Prüfzentren werden im Laufe des Jahres 2024 hinzukommen.
Durchführung: Es ist geplant, 411 Patienten in die Studie einzuschließen. Insgesamt wird die Studie an ca. 90 Zentren in Deutschland und Österreich durchgeführt. Die Patienten werden auf zwei Studienarme randomisiert. In beiden Armen bekommen die Patienten Iberdomid in 39 Zyklen, in denen das Medikament jeweils durchgehend 21 Tage lang oral eingenommen wird, gefolgt von einer einwöchigen Pause. Im Arm B wird zusätzlich das Medikament Isatuximab, wie bereits in der GMMG-HD8/DSMM XIX, mithilfe eines Injektors unter die Haut am Bauch gespritzt. Im ersten Zyklus erfolgt die Verabreichung des Isatuximabs einmal in der Woche, in den Zyklen 2 und 3 vierzehntägig, und ab dem Zyklus 4 bis zum Ende der Studie alle 4 Wochen. Die Überlegenheit der Hinzunahme von Isatuximab zu Iberdomid wird hinsichtlich der Raten der minimalen Resterkrankung (minimal residual disease, MRD) im Knochenmark mit einer Sensitivität von einer Krebszelle pro 500.000 Zellen geprüft. Die Untersuchungen erfolgen mithilfe eines spezialisierten Durchflusszytometrie-Verfahrens (Next Generation Flow, NGF). Als sekundärer Endpunkt dient das progressionsfreie Überleben vom Zeitpunkt des Einschlusses bis zum Progress oder dem Tod.
Studiendesign: Prospektive, multizentrische, randomisierte, unverblindete Phase-III-Studie zur Erstlinientherapie von transplantierbaren MM-Patienten.